Fälschungsschutz
Gemäß Art. 54a Abs. 1 der durch die EU-Fälschungsschutzrichtlinie 2011/62/EU (FMD) geänderten Richtlinie 2001/83/EG sind verschreibungspflichtige Arzneimittel grundsätzlich mit Sicherheitsmerkmalen zu kennzeichnen. Diese ermöglichen die Identifizierung von Einzelpackungen und eine Überprüfung ihrer Echtheit.
Die Eigenschaften und technischen Spezifikationen des individuellen Erkennungsmerkmals für die Sicherheitsmerkmale sind in der delegierten Verordnung (EU) 2016/161 der Kommission vom 2. Oktober 2015 festgelegt und wurden am 9. Februar 2016 im Europäischen Amtsblatt veröffentlicht. Die Akteure der legalen pharmazeutischen Lieferkette in Deutschland haben diese Vorgaben seit dem 9. Februar 2019 umzusetzen. Seit diesem Stichtag dürfen keine von der Fälschungsschutzrichtlinie betroffenen Produkte mehr ohne die Sicherheitsmerkmale in Verkehr gebracht werden.
Die Verordnung sieht ein System vor, in dem alle Arzneimittel, welche die Sicherheitsmerkmale tragen, durch eine End-to-end-Verifizierung identifiziert und auf ihre Echtheit überprüft werden können.
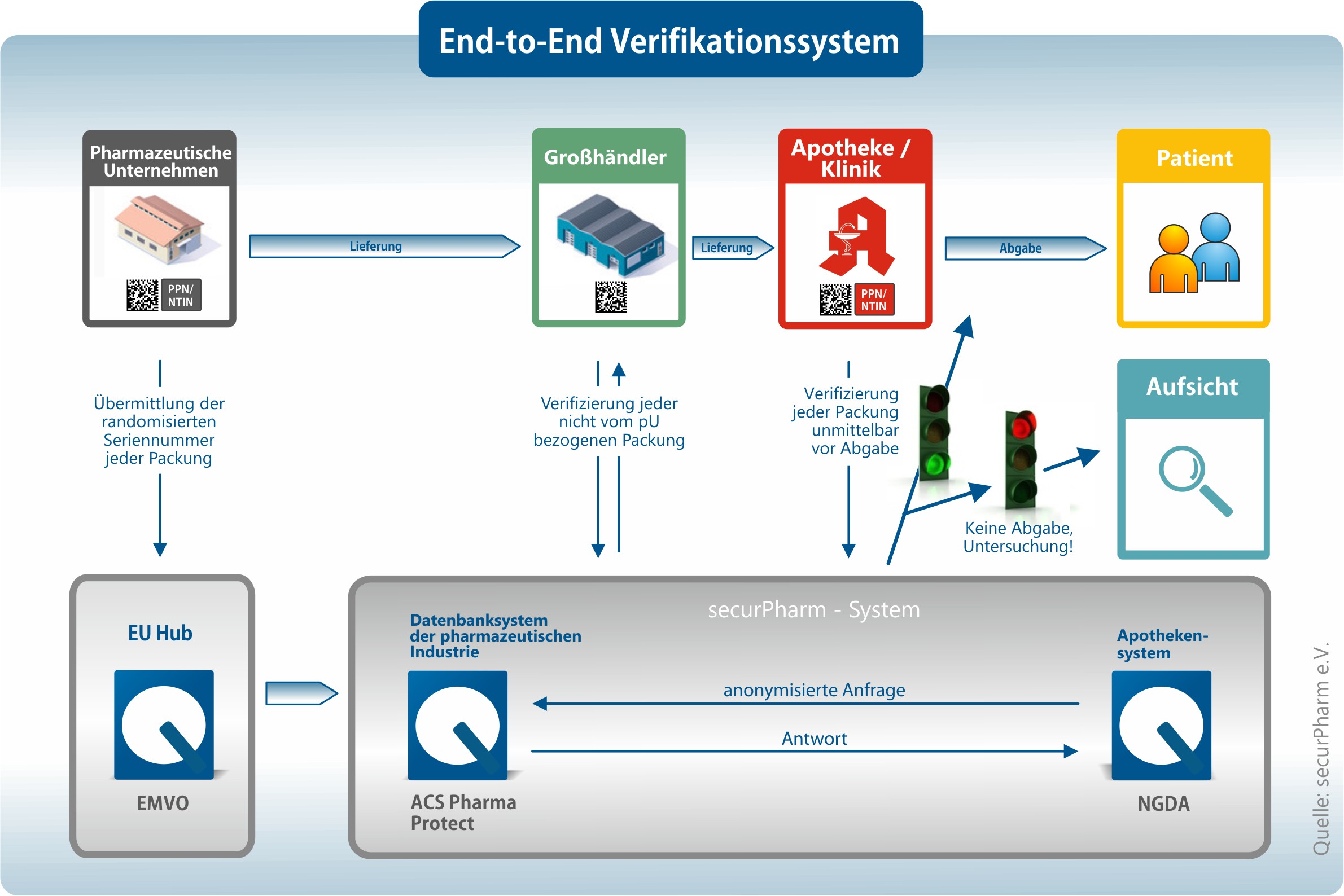

Die dazu notwendige Kennzeichnung und Codierung der Handelspackungen sind nach den Codierregeln von securPharm vorzunehmen.
Die Spezifikation PPN-Code für Handelspackungen setzt diese Regeln um. Sie enthält alle Elemente der securPharm-Codierregeln in identischer Form.



 IFA-Wegweiser
IFA-Wegweiser